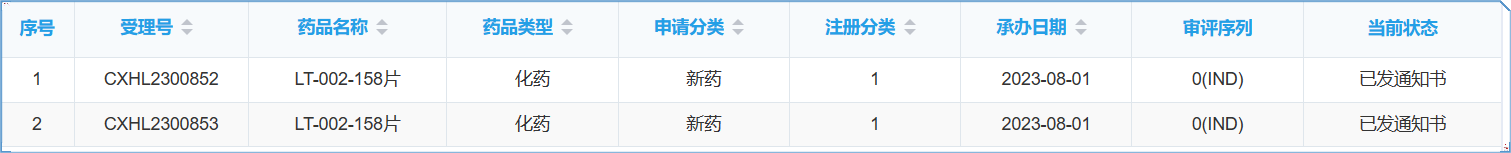
近期,领泰生物的IRAK4新型蛋白降解剂获得中国国家药品监督管理局(NMPA)药品审评中心CDE批准开展临床I期试验,适应症为化脓性汗腺炎(Hidradenitis Suppurativa, HS),另一适应症特异性皮炎(Atopic Dermatitis, AD)的申请正在审阅中。该管线已于2023年5月24日获得美国食品药品监督管理局(FDA)正式批准(NCT06082323),主要用于治疗化脓性汗腺炎(Hidradenitis Suppurativa, HS)和特异性皮炎(Atopic Dermatitis, AD)。
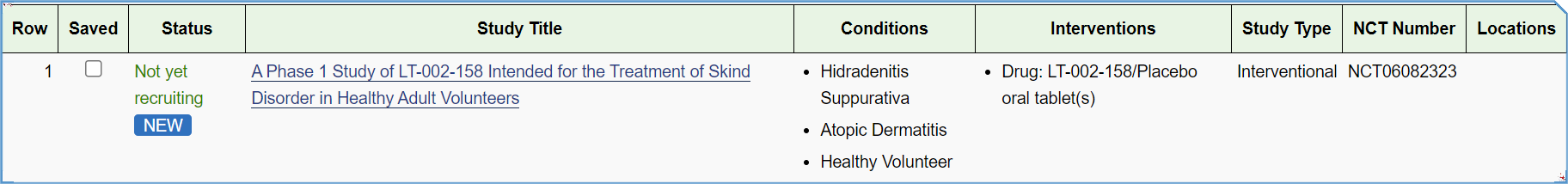
NCT Number:NCT06082323
领泰生物创始人兼首席执行官冯焱博士表示:IRAK4降解剂作为公司的首个管线获得中国CDE批准开展临床I期试验,是公司发展的又一个重要里程碑。除了IRAK4降解剂LT-002之外,其他管线蛋白降解剂的开发也展现出良好的前景,其中第二个管线的临床前候选化合物PCC已经选定,计划于2024年年底推进到临床。第三个管线的先导化合物正在优化,预计于2025年Q1提交IND申请。在此,由衷地感谢公司全体员工的不懈努力,今后,领泰生物将继续努力,不忘初心,砥砺前行。我们期待以PROTAC的技术优势,为患者带去更多的可能,贡献领泰生物的力量。
关于IRAK4降解剂:
IRAK4(白细胞介素-1受体相关激酶4)是人体IRAK激酶家族同工酶之一,在蛋白质磷酸化以及细胞信号转导中发挥了重要作用。它接收来自上游toll样受体家族(TLRs)以及白细胞介素-1型受体家族(IL-1R)的信号,对其下游的NF-κB以及JNK信号通路进行激活,对人类的炎症反应和肿瘤具有重要作用。IRAK4蛋白同时具有激酶活性以及支架功能,因此利用降解剂对其进行降解能同时阻断IRAK4的激酶功能以及支架功能,从而实现对信号通路的完全抑制,发挥良好的抗炎和抗肿瘤活性。
领泰生物的IRAK4降解剂LT-002是继Kymera的KT-474之后向FDA提交IND申请的国内首创、全球第二的IRAK4蛋白降解剂。该分子是基于领泰现有的蛋白降解新药研发平台Nano-SPUD®筛选得到的。在临床前动物模型上,该分子表现出了很强的改善皮肤炎症症状的活性和良好的安全性。
关于领泰生物:
领泰生物创建于2019年,是一家致力于First-in-class/Best-in-class小分子创新药研发的生物制药企业,以靶向蛋白降解 (Targeted Protein Degradation, TPD) 药物研发技术为核心,聚焦于自身免疫和肿瘤这两个具有重要市场机遇和协同效应的治疗领域,为患者提供突破性治疗方案。领泰生物坐落于中国上海张江科学城,现有实验室及办公面积近1000平方米,正式员工20人,成立4年至今已完成融资近亿元。